Relator: Dr. Marco Aurélio P. Sáfadi
Professor Assistente de Pediatria da F.C.M. da. Santa Casa de São Paulo, Presidente do Departamento Científico de Imunizações da SPSP.
Texto divulgado em 13/03/2017
1. Introdução:
Frente à importância do cenário epidemiológico atual da febre amarela em nosso país (tabela 1), o Departamento de Imunizações da Sociedade de Pediatria de São Paulo preparou um documento de alerta para os profissionais da saúde, destacando os principais aspectos relacionados ao vírus causador da doença, sua transmissão, situação epidemiológica, manifestações clínicas, diagnóstico, manejo terapêutico, com especial ênfase às recomendações atuais de uso da vacina.
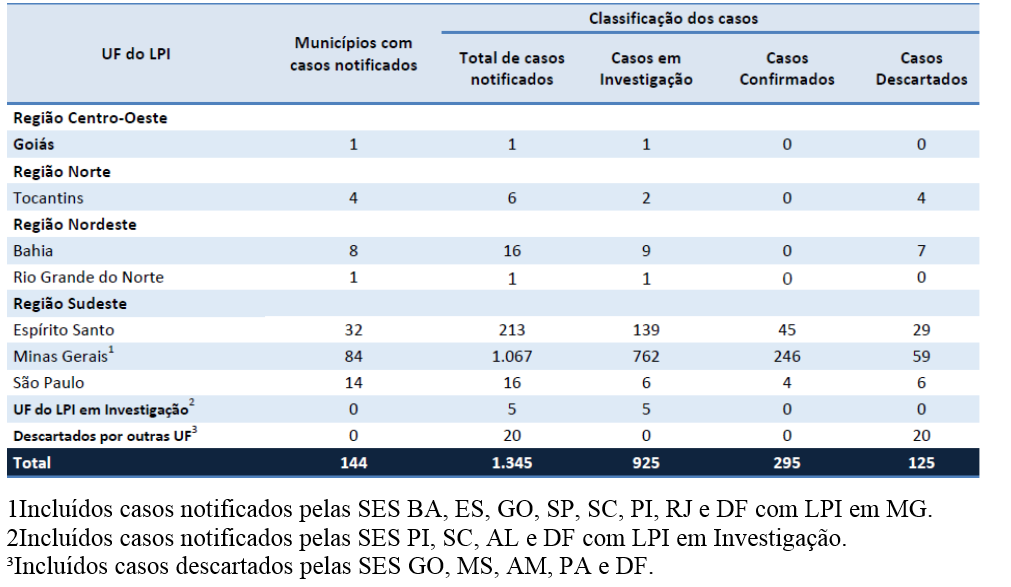
Tabela 1 – Distribuição dos casos de febre amarela notificados à SVS/MS até 23 de fevereiro de 2017, às 13h, com início dos sintomas a partir de 01 dezembro de 2016, por UF do Local Provável de Infecção (LPI) e classificação1.
2. Etiologia:
O vírus da febre amarela é um RNA vírus da família Flaviviridae, que pertence ao gênero Flavivirus, relacionado aos vírus dengue, zika, encefalite japonesa e do Oeste do Nilo. Já foram identificados pelo menos 7 diferentes genótipos, 5 deles em circulação na África e dois na América do Sul. Entretanto, existe apenas um sorotipo do vírus, antigenicamente conservado, o que antecipa proteção universal da vacina em relação às várias cepas circulantes do vírus da febre amarela. O vírus da febre amarela tem como características o viscerotropismo (capacidade de infectar e lesar o fígado, baço, rins e o coração) e o neurotropismo (capacidade de infectar e lesar o parênquima cerebral e causar encefalite)2-4.
3. Transmissão:
O vírus é transmitido ao homem pela picada do mosquito (espécies Aedes ou Haemagogus) infectado. Após a inoculação, o vírus inicia sua replicação nas células dendríticas da epiderme, espalhando-se pelos canais linfáticos aos linfonodos e daí para os órgãos do corpo através da circulação sanguínea. Os mosquitos adquirem o vírus ao picar primatas humanos e não humanos infectados, durante a fase virêmica (esta fase dura em média 3 a 6 dias, tendo seu início imediatamente antes dos primeiros sintomas e persistindo por aproximadamente 5 dias).
O homem é susceptível à infecção e à doença. A maioria dos primatas não humanos é susceptível à infecção, sendo apenas algumas espécies capazes de desenvolver manifestações clínicas de doença quando infectadas5,6.
A febre amarela apresenta dois ciclos de transmissão epidemiologicamente distintos: silvestre e urbano7 (figura 1):
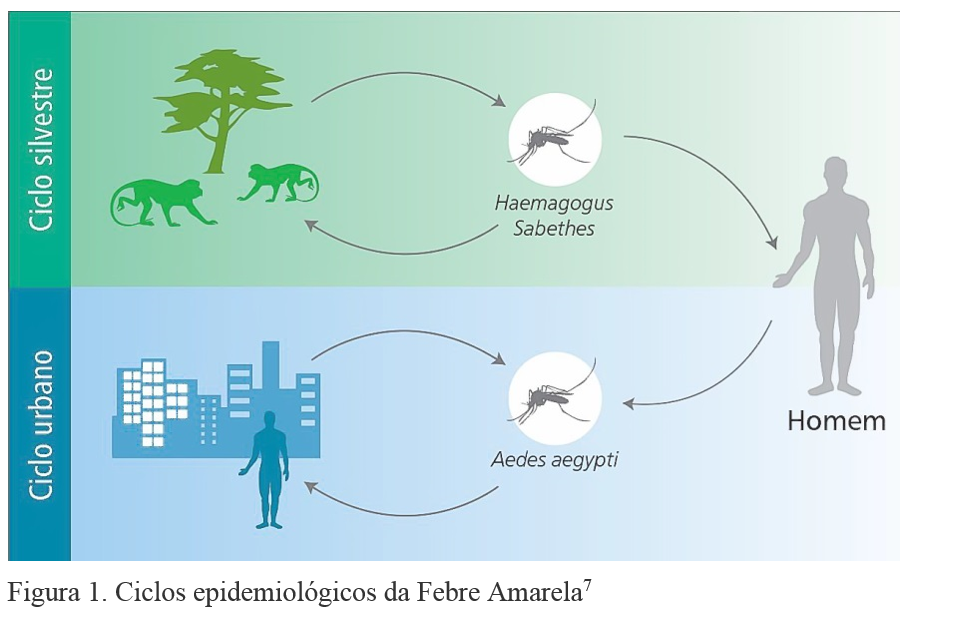
- Silvestre: este ciclo envolve transmissão do vírus entre primatas não humanos (macacos) e espécies de mosquitos encontradas nas florestas tropicais (principalmente mosquitos dos gêneros Sabethes e Haemagogus). Os mosquitos adquirem o vírus ao picar macacos infectados e o transmitem a humanos que adentram a mata. O homem é, portanto, considerado um hospedeiro acidental na febre amarela silvestre. De maneira geral estes casos esporádicos ocorrem em trabalhadores rurais, na sua maioria jovens, do sexo masculino.
- Urbano: o ciclo urbano envolve transmissão do vírus entre humanos, tendo como vetor principal o Aedes aegypti e como único reservatório e hospedeiro, o homem.
4. Manifestações clínicas:
As manifestações clínicas da doença são bastante variadas, desde formas assintomáticas até formas bastante graves, potencialmente letais, da doença. O período de incubação é de aproximadamente 3 a 6 dias. Didaticamente podemos dividir as manifestações da doença em três fases distintas: infecção, remissão e tóxica8,9:
- Fase de infecção: após o período de incubação, nos casos sintomáticos, a doença caracteriza-se pela presença de febre, cefaleia, mialgia, náuseas, vômitos, astenia e congestão conjuntival. Os pacientes apresentam viremia nesta fase, que costuma durar 3 ou 4 dias. O quadro clínico é inespecífico e de difícil distinção de outras infecções. Pode-se observar em alguns casos a presença de bradicardia, mesmo na presença de febre (esta dissociação pulso/temperatura é chamada de sinal de Faget). Entre as alterações laboratoriais, encontramos leucopenia com neutropenia relativa e aumento de transaminases10.
- Fase de remissão: A maioria apresenta regressão dos sintomas e se recupera após esta fase. Entretanto, em aproximadamente 15% dos casos, após uma breve remissão dos sintomas, os pacientes evoluem para a terceira fase da doença.
- Fase tóxica: Caracteriza-se por uma forma grave, toxêmica, com retorno da febre, cefaleia e mialgia acentuadas, icterícia, epistaxe, dor epigástrica, hematêmese, melena, sangramentos em locais de punção venosa e outras manifestações hemorrágicas, podendo instalar-se quadro de insuficiência hepato-renal com evolução para coma e morte.
Ainda não é claro o papel que infecções prévias por outros Flavivirus podem ter na maior ou menor gravidade das formas clínicas de febre amarela. As taxas de letalidade nos pacientes que evoluem para a fase tóxica são de 20% a 50%. Entre os sinais de mal prognóstico, podemos destacar a presença de anúria, choque, hipotermia, agitação, convulsões, distúrbios metabólicos graves, irregularidade respiratória e coma2, 8-11.
5. Diagnóstico:
Os métodos utilizados para o diagnóstico laboratorial da febre amarela incluem2, 7,8,11:
- Isolamento do vírus e/ou detecção do RNA viral por técnicas de biologia molecular (reação em cadeia de polimerase – RT-PCR).
Após o início dos sintomas, durante a fase aguda febril, o diagnóstico pode ser feito por isolamento do vírus ou detecção de RNA viral por meio de reação em cadeia de polimerase por transcriptase reversa (RT-PCR). O período adequado para a realização do teste para isolamento do vírus e/ou detecção do RNA viral é até o sétimo dia do início dos sintomas.
- Detecção de antígeno viral em amostras de material histopatológico por técnicas imunohistoquímicas com fixação por formalina.
- Provas sorológicas (pesquisa de anticorpos da classe IgM e IgG por ELISA ou inibição de hemaglutinação).
A presença de anticorpos da classe IgM pode ser detectada apenas a partir de 5 dias após o início dos sintomas (tabela 2). Recomenda-se, portanto, que a sorologia seja idealmente feita após o 6º dia de sintomas. Atenção deve ser dada para a possibilidade de reações falso-positivas em indivíduos previamente expostos a outros Flavivirus ou que receberam vacina de febre amarela. Desta forma, resultados positivos devem ser confirmados através de provas mais específicas (PRNT – teste por neutralização de redução de placas).
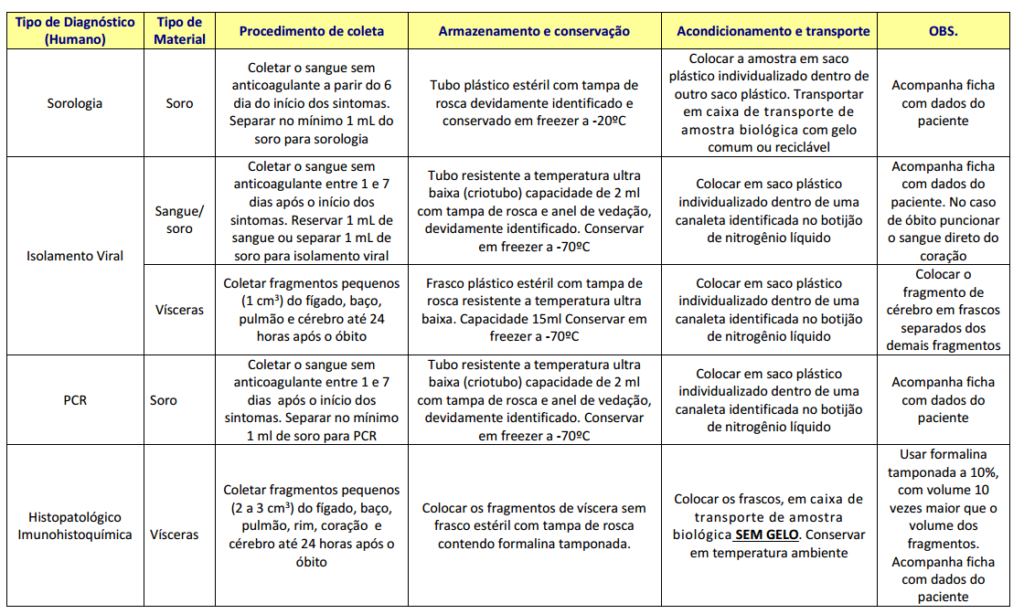
Tabela 2: Fluxograma de diagnóstico proposto pelo Ministério da Saúde7
Entre os achados laboratoriais inespecíficos podemos destacar a leucopenia, como achado frequente já nos primeiros dias de sintomas. Os casos graves podem apresentar, plaquetopenia (muitas vezes com menos de 50.000/mm³), aumento dos tempos de protrombina, tromboplastina parcial e coagulação, presença de fatores de degradação de fibrina, aumento dos níveis de uréia e creatinina, além de hiperbilirrubinemia e elevação das transaminases11.
6. Aspectos epidemiológicos:
No Brasil, a partir do desaparecimento da forma urbana em 1942, só há ocorrência de casos de febre amarela silvestre. A maior parte do nosso território é considerado endêmico para a doença, excetuando-se a região litorânea. A doença acomete com maior frequência indivíduos do sexo masculino, com mais de 15 anos, em função da maior exposição profissional destes indivíduos, relacionada à penetração em zonas silvestres de áreas endêmicas. Outro grupo de risco são pessoas não vacinadas que residem próximas aos ambientes silvestres, onde circula o vírus, além de turistas e migrantes que adentram esses ambientes8-11.
A maior frequência da doença ocorre nos meses de janeiro a abril, período com maior índice pluviométrico, quando a densidade vetorial é elevada, coincidindo com a época de maior atividade agrícola. Na população humana, o aparecimento de casos é geralmente precedido de epizootias em primatas não humanos.
Todos os casos suspeitos em humanos e epizootias em primatas não humanos (macacos) devem ser notificados e investigados imediatamente, em até 24 horas, visando identificar as áreas de circulação viral, as populações sob risco e as áreas prioritárias para aplicação de medidas de prevenção e controle.
Definição de caso suspeito e classificação final7, 11
Definição de caso suspeito: Indivíduo com quadro febril agudo (até 7 dias), de início súbito, acompanhado de icterícia e/ou manifestações hemorrágicas, residente ou procedente de área de risco para febre amarela ou de locais com ocorrência de epizootias em primatas não humanos, ou isolamento de vírus em vetores, nos últimos 15 dias não vacinados contra febre amarela ou com estado vacinal ignorado.
Classificação final
Caso confirmado
- Critério clínico-laboratorial
Todo caso suspeito que apresente pelo menos uma das seguintes condições:
- Isolamento do vírus da febre amarela;
- Detecção do genoma viral;
- Detecção de anticorpos da classe IgM pela técnica de MAC-ELISA em indivíduos não vacinados ou com aumento de 4 vezes ou mais nos títulos de anticorpos pela técnica de inibição da hemaglutinação (IH), em amostras pareadas;
- Achados histopatológicos com lesões nos tecidos compatíveis com febre amarela.
- Será considerado também caso confirmado o indivíduo assintomático ou oligossintomático, originado de busca ativa, que não tenha sido vacinado e que apresente sorologia (MAC-ELISA) positiva ou positividade por outra técnica laboratorial conclusiva para a febre amarela.
- Critério de vínculo epidemiológico
Todo caso suspeito de febre amarela que evoluiu para óbito em menos de 10 dias, sem confirmação laboratorial, em período e área compatíveis com surto ou epidemia, em que outros casos já tenham sido confirmados laboratorialmente.
Caso descartado:
Caso suspeito com diagnóstico laboratorial negativo, desde que comprovado que as amostras foram coletadas em tempo oportuno para a técnica laboratorial realizada; ou caso suspeito com diagnóstico confirmado de outra doença.
Situação epidemiológica atual:
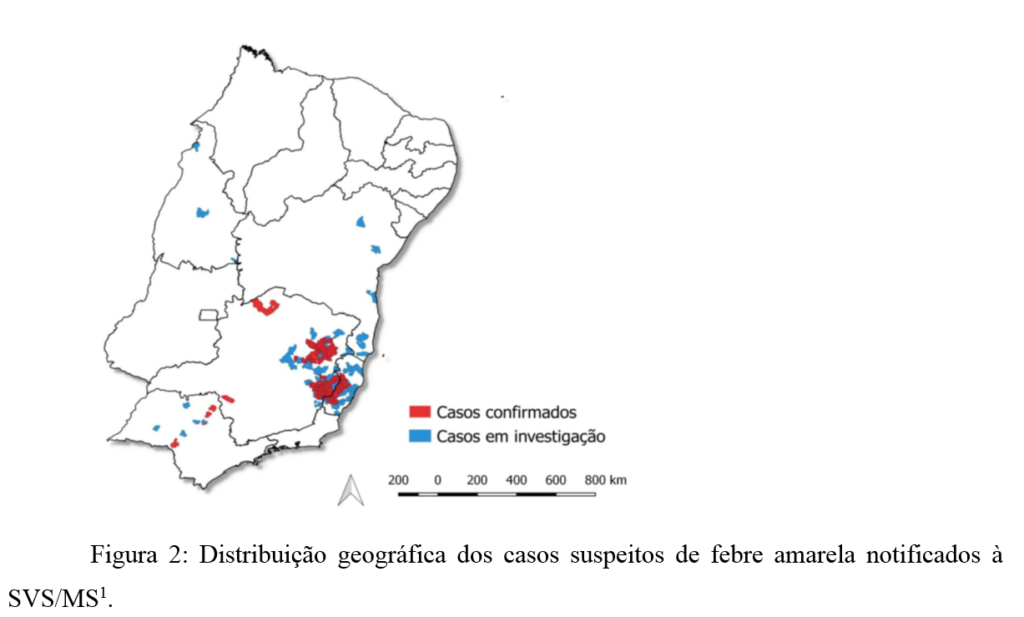
A partir de Dezembro de 2016, até o dia 23 de fevereiro de 2017, foram notificados ao Ministério da Saúde 1.345 casos suspeitos de febre amarela silvestre, desses, 925 (68,8%) casos permanecem em investigação, 295 (21,9%) casos foram confirmados e 125 (9,3%) foram descartados. Os casos confirmados tiveram como local provável de infecção os estados de São Paulo (4 casos), Espirito Santo (45 casos) e Minas Gerais (246 casos)1 – figura 2.
O perfil demográfico dos casos confirmados coincide com aquele geralmente observado nos surtos de febre amarela silvestre, com a maior parte dos casos em pacientes do sexo masculino (87% dos casos) e idade economicamente ativa, uma vez que esses indivíduos se expõem com maior frequência a áreas e situações de risco, sobretudo em decorrência de atividades laborais1 (figura 3).
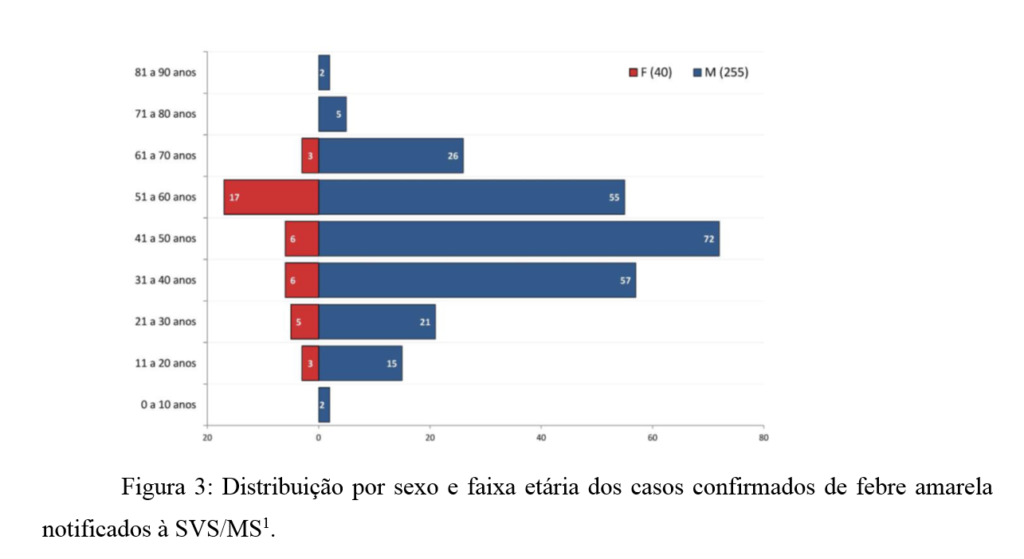
Do total de casos, 215 evoluíram para óbito, sendo que 108 (50,2%) óbitos permanecem em investigação, 101 (47,0%) óbitos foram confirmados e 06 foram descartados (2,8%). A taxa de letalidade entre os casos confirmados foi de 34,2%.
Neste mesmo período foram notificadas ao Ministério da Saúde 883 epizootias em Primatas Não Humanos (PNH), das quais 212 permanecem em investigação, 08 foram descartadas e 377 foram confirmadas para febre amarela por critério laboratorial ou vínculo epidemiológico com epizootias em PNH ou casos humanos confirmados em áreas afetadas (municípios com evidência de circulação viral) e ampliadas (municípios limítrofes àqueles afetados)1.
7. Tratamento:
O tratamento consiste em medidas de suporte, não havendo medicamentos específicos contra o vírus da febre amarela.
- Evitar o uso de anti-inflamatórios e ácido acetilsalicílico (AAS).
8. Prevenção com vacinas:
A maneira mais efetiva de se proteger contra a Febre Amarela é a vacinação.
A vacina atualmente utilizada é composta de vírus vivos atenuados, derivada da cepa 17D. No Brasil existem duas formulações de vacina, uma delas disponível nas unidades de saúde pública (cepa 17DD, produzida em Bio-Manguinhos, Fundação Osvaldo Cruz, RJ) e a outra em clínicas privadas (cepa 17D204, produzida pelo laboratório Sanofi-Pasteur). Estudos comprovaram a equivalência de resposta imune entre as duas formulações12. Cada dose da vacina corresponde a 0,5 mL e administração é subcutânea7.
Atualmente, o esquema completo da imunização contra a febre amarela, recomendado pelo Ministério da Saúde no Brasil, consiste em duas doses da vacina, tanto para adultos como para crianças. A idade mínima para vacinação é de 9 meses de idade. Apenas nas situações de epizootias a idade mínima será de 6 meses de idade.
A vacina é de elevada imunogenicidade, com detecção de anticorpos neutralizantes em 90% dos vacinados já no 10º dia e em mais de 99% após 4 semanas da vacinação5, 13, 14. Em uma metanálise de estudos que avaliaram a resposta sorológica em vacinados, os autores encontraram que 97,5% dos indivíduos previamente vacinados apresentavam evidência de soroconversão15. Não é conhecido o correlato de proteção contra a doença (ou seja, o nível de anticorpos necessário para assegurar proteção contra a doença em seres humanos)2. Os estudos realizados sugerem que a duração de proteção após uma dose da vacina é longa, provavelmente por toda a vida16. Entretanto, considerando-se a queda na imunidade com o tempo decorrido após a vacinação, demonstrada em alguns estudos17, além da menor imunogenicidade da vacina quando administrada em crianças pequenas, especialmente em lactentes, o Ministério da Saúde no Brasil manteve a recomendação de uma segunda dose de reforço.
Recomendações de quais pessoas devem ser vacinadas:
O Ministério recomenda a vacinação nas ações de rotina dos programas de imunizações (Calendário Nacional de Vacinação), em residentes da Área Com Recomendação de Vacina (http://bit.ly/mun_vacina_fa) e em viajantes que se deslocam para essa área, conforme o mapa abaixo (figura 4). Nestes casos, a vacina deve ser administrada pelo menos 10 dias antes da viagem, no caso de primeira vacinação. O prazo de 10 dias não se aplica no caso de revacinação7,11.
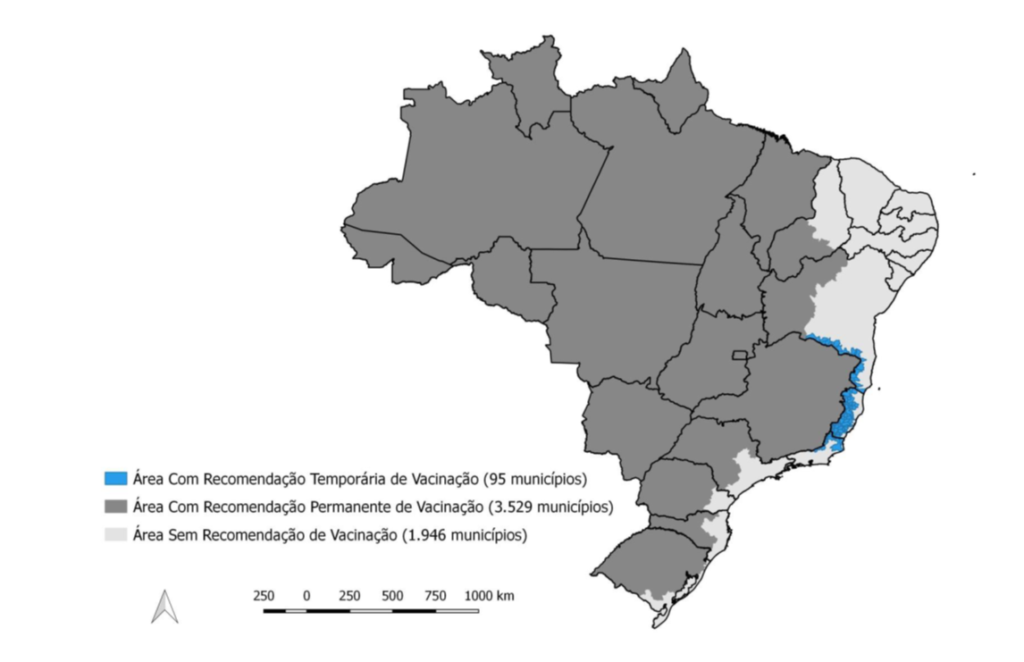
Figura 4 – Distribuição dos municípios segundo a recomendação de vacinação para controle de surto e prevenção da Febre Amarela, Brasil, 20171.
Vacinas concomitantes:
Lembramos, ainda, que para evitar interferência na proteção conferida pelas vacinas, a vacina para febre amarela não deve ser administrada ao mesmo tempo que a vacina tríplice viral (contra sarampo, rubéola e caxumba) ou tetra viral (contra sarampo, rubéola, caxumba e varicela) em crianças menores de 2 anos de idade18. Para crianças que não receberam a vacina para febre amarela nem a tríplice viral ou tetra viral, a orientação é que recebam a dose da vacina de Febre Amarela e agendem a vacina tríplice viral ou tetra viral para pelo menos 30 dias depois. As demais vacinas do calendário podem ser administradas no mesmo dia que a vacina de febre amarela.
Quais são as situações em que a vacina está contraindicada?
- História de reação anafilática relacionada a substâncias presentes na vacina (ovo de galinha e seus derivados, gelatina bovina ou outras)
- Idade < 6 meses
- Infecção por HIV sintomática ou CD4+ <200/mm3 (<15% do total em crianças < 6 anos)
- Disfunções do Timo associadas com função imune alterada
- Imunodeficiências primárias
- Neoplasias malignas
- Pacientes em terapêutica imunodepressora: quimioterapia, radioterapia, corticoide em doses elevadas (equivalente a prednisona na dose de 2mg/kg/dia ou mais para crianças, ou 20 mg/dia ou mais, para adultos, por mais de duas semanas).
Situações especiais:
Gestantes:
A vacinação não deve ser realizada em gestantes. Entretanto, em situações de emergência epidemiológica ou na impossibilidade de adiar viagem para área de risco de contrair a doença, o médico deverá avaliar o benefício/risco da vacinação.
Mulheres que estejam amamentando crianças com até 6 meses de idade:
Os relatos de transmissão do vírus vacinal da febre amarela através do leite materno a lactentes causando encefalite19, 20, motivaram a revisão das recomendações da vacina em mulheres que estejam amamentando crianças de até 6 meses de idade. Nesta situação a vacinação está contraindicada, devendo ser adiada até a criança completar 6 meses de idade. Na impossibilidade de adiar a vacinação, como em situações de emergência epidemiológica, vigência de surtos, epidemias ou viagem para área de risco de contrair a doença, o médico deverá avaliar o benefício/risco da vacinação. Em caso de mulheres que estejam amamentando e foram vacinadas o aleitamento materno deverá ser suspenso preferencialmente por 28 dias após a vacinação (com um mínimo de 15 dias).
Vacinação para as pessoas após os 60 anos ou mais de idade:
De acordo com a literatura internacional, a primovacinação em pessoas após os 60 anos de idade, apresenta maior risco de evento adverso grave21, 22. Importante destacar que a vacina não está contraindicada para pessoas após os 60 anos de idade que residem ou que irão viajar para áreas de risco. As pessoas imunodeprimidas não devem ser vacinadas, ou seja, a vacina é contraindicada para as pessoas que fazem tratamento com quimioterapia e/ou radioterapia e utilizam corticosteroides em dose imunosupressora.
Pessoas que vivem com o HIV:
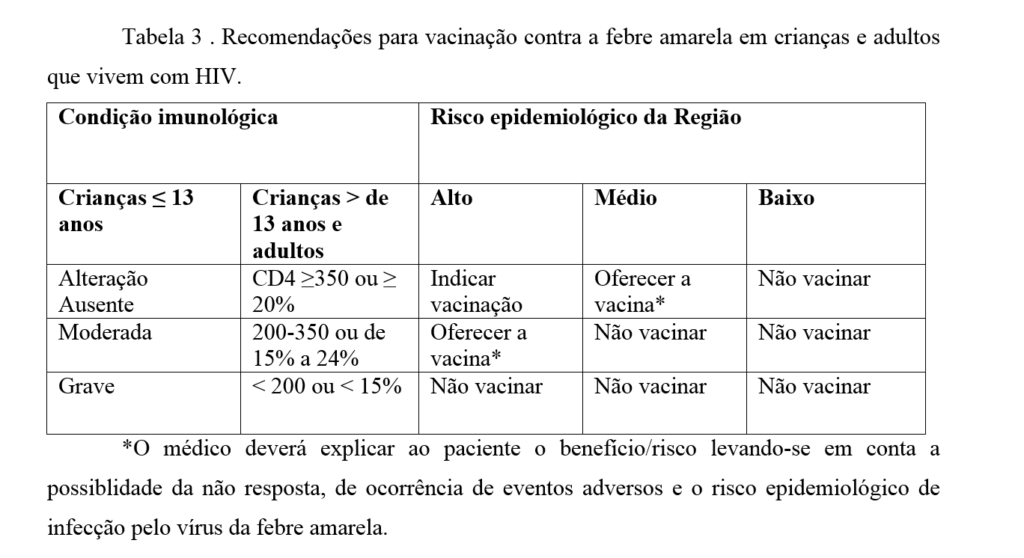
A administração da vacina de febre amarela deverá levar em conta a condição imunológica do paciente que vive com HIV e a situação epidemiológica do local onde a vacinação está sendo indicada23 (tabela 3).
Tabela 3 . Recomendações para vacinação contra a febre amarela em crianças e adultos que vivem com HIV.
Situações em que se recomenda o adiamento da vacinação:
- até três meses após o tratamento com imunodepressores ou com corticóides em dose elevada.
- vigência de doenças febris graves, sobretudo para que seus sinais e sintomas não sejam atribuídos ou mesmo confundidos com os possíveis eventos da vacina.
Transfusões de sangue e hemoderivados:
O vírus vacinal da febre amarela pode ser transmitido por meio de transfusões de sangue e hemoderivados24. Recomendamos, portanto, que indivíduos vacinados devem adiar a doação de sangue e/ou hemoderivados por pelo menos 15 dias.
Esquemas de vacinação preconizados:
Em maio de 2014 a Organização Mundial da Saúde (OMS) alterou o Regulamento Sanitário Internacional, estabelecendo que uma dose da vacina de febre amarela seja considerada suficiente para proteção por toda a vida, estendendo a validade do certificado internacional de vacinação contra febre amarela para apenas uma dose da vacina para toda a vida25.
O Ministério da Saúde do Brasil analisou as evidências científicas disponíveis sobre a duração da imunidade pela vacina febre amarela, a situação epidemiológica da febre amarela no Brasil, e decidiu manter a recomendação de uma segunda dose da vacina. As crianças devem receber as duas doses da vacina aos nove meses e aos quatro anos de idade. Para crianças maiores de 5 anos, adolescentes e adultos, não vacinados anteriormente, a orientação é administrar uma dose da vacina e outra dose de reforço, dez anos depois da primeira.
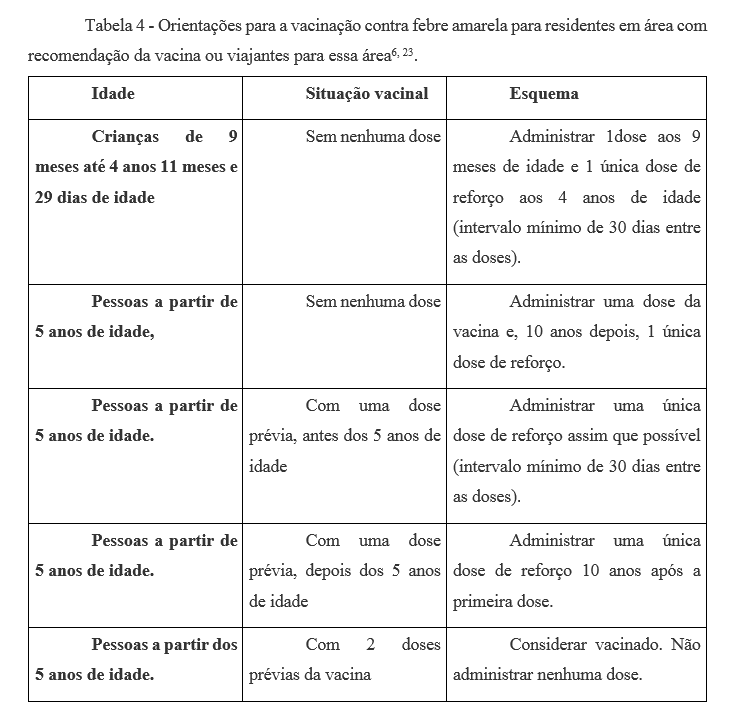
Na tabela abaixo contemplamos as atuais recomendações e esquemas de vacinação no Estado de São Paulo, de acordo com as orientações do Ministério da Saúde:
Tabela 4 – Orientações para a vacinação contra febre amarela para residentes em área com recomendação da vacina ou viajantes para essa área6, 23.

Eventos adversos:
A vacina febre amarela é de maneira geral bem tolerada. A partir do 3º- 4º dia da vacinação podemos observar, em aproximadamente 2% a 5% dos vacinados, febre, dor de cabeça, dores musculares, entre outros sintomas21,26. Eventos adversos graves (reações anafiláticas, doença viscerotrópica e doença neurológica) foram raramente associados à vacina. No Brasil, entre 2007 e 2012, foram relatados aproximadamente 1 evento adverso grave em cada 250.000 doses administradas10. Nos Estados Unidos, entre 2000 e 2006, o sistema de vigilância de eventos adversos após vacinas (VAERS) identificou uma taxa de 4,7 eventos adversos graves para cada 100.000 doses de vacina distribuídas13. Desta forma, enfatizamos a orientação de só realizar a vacina em indivíduos com recomendações de uso.
Eventos adversos graves:
- Reações anafiláticas e hipersensibilidade imediata. Estima-se que o risco seja de 0,8 casos por 100.000 doses de vacina.
- Doença neurológica associada à vacina: eventos neurológicos desencadeados por invasão direta do vírus vacinal no SNC resultando em meningite ou encefalite, ou reações auto-imunes como a síndrome de Guillain-Barré ou encefalomielite difusa aguda (ADEM). Ocorre usualmente 2 a oito dias após a vacinação, sendo na maioria das vezes de evolução auto-limitada. O risco estimado é de 0,25 – 0,8 casos por 100.000 doses de vacina. Existe uma tendência de maior risco em idosos13.
- Doença viscerotrópica associada à vacina: causada por replicação e disseminação do vírus vacinal de maneira similar ao vírus selvagem. Leva a falência de múltiplos órgãos com letalidade de 60%. Ocorre geralmente três a cinco dias após a vacinação. Estima-se o risco em 0,25 a 0,4 casos por 100.000 doses de vacina (maior risco observado na primovacinação de idosos)13.
9. Controle do vetor e medidas individuais de prevenção:
Finalmente, vale destacar que o controle do vetor Aedes aegypti através de métodos físicos, biológicos e químicos, é medida fundamental para prevenir a transmissão em áreas urbanas, onde este mosquito atua como principal transmissor. Fortalecer as ações de combate vetorial nos municípios situados próximos às áreas de transmissão, visando reduzir os índices de infestação para zero, assim como orientar o uso de proteção individual das pessoas que vivem ou adentram áreas enzoóticas ou epizoóticas são medidas importantes para diminuir o risco de infecção11.
Referências:
1. Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Monitoramento dos casos e óbitos de febre amarela no Brasil. INFORME – Nº 23/2017. Disponível em http://portalarquivos.saude.gov.br/images/pdf/2017/fevereiro/24/COES-FEBRE-AMARELA-INFORME23-Atualizacao-23fev2017-13h.pdf
2. Centers for Disease Control and Prevention (CDC). Yellow Fever. Available at: https://www.cdc.gov/yellowfever/. Acessado em 20/Fev/2017.
3. Mutebi JP, Wang H, Li L, et al. Phylogenetic and evolutionary relationships among yellow fever virus isolates in Africa. J Virol 2001; 75:6999.
4. Vasconcelos PF, Bryant JE, da Rosa TP, et al. Genetic divergence and dispersal of yellow fever virus, Brazil. Emerg Infect Dis 2004; 10:1578.
5. Monath, T.P., Gershman, M., Staples, E.J., Barrett, A.D.T. Yellow fever vaccine. in: S.A. Plotkin, W.A. Orenstein, P.A. Offit (Eds.) Vaccines. 6th ed. Saunders Elsevier, ; 2012:870–896
6. Monath TP, Brinker KR, Chandler FW, et al. Pathophysiologic correlations in a rhesus monkey model of yellow fever with special observations on the acute necrosis of B cell areas of lymphoid tissues. Am J Trop Med Hyg 1981; 30:431.
7. Brasil. Ministério da Saúde. Orientação para Profissionais de Saúde sobre Febre Amarela Silvestre. Disponível em http://portalsaude.saude.gov.br/index.php/informacoes-tecnicas-febreamarela
8. Sato H. Febre Amarela. In: Farhat CK, Weckx L, Carvalho LH, Succi RC. Imunizações: Fundamentos e Prática. 5 ed. Atheneu, 2008; 460-477.
9. Barnett ED. Yellow fever: epidemiology and prevention. Clin Infect Dis 2007; 44:850.
10. Tuboi SH, Costa ZG, da Costa Vasconcelos PF, Hatch D. Clinical and epidemiological characteristics of yellow fever in Brazil: analysis of reported cases 1998-2002. Trans R Soc Trop Med Hyg 2007; 101:169.
11. Brasil. Ministério da Saúde. Nota Informativa Situação epidemiológica da Febre Amarela no Brasil. Disponível em http://portalarquivos.saude.gov.br/images/pdf/2017/janeiro/13/NOTA-INFORMATIVA-N—02-2017-FA-FINAL.pdf
12. Camacho L, Freire M, Leal M et al. Immunogenicity of WHO-17D and Brazilian 17DD yellow fever vaccines: a randomized trial. Rev. Saúde Pública. 2004; 38 (5):671-8
13. Centers for Disease Control and Prevention (CDC). Yellow Fever Vaccine: Recommendations of the Advisory Committee on Immunization Practices (ACIP) Recommendations and Reports July 30, 2010 / 59(RR07);1-27
14. World Health Organization. Vaccines and vaccination against yellow fever. WHO position paper – June 2013. Wky Epidemiol Rec 2013; 88:269–84.
15. Jean K, Donnelly CA, Ferguson NM, Garske T. A Meta-Analysis of Serological Response Associated with Yellow Fever Vaccination. Am J Trop Med Hyg 2016; 95:1435.
16. Gotuzzo, E., Yactayo, S., Cordova, E. Efficacy and duration of immunity after yellow fever vaccination: systematic review on the need for a booster every 10 years. Am J Trop Med Hyg. 2013; 89:434–444
17. Collaborative group for studies on yellow fever vaccines. Duration of post-vaccination immunity against yellow fever in adults. Vaccine. 2014; 32:4977–4984
18. Nascimento Silva JR, Camacho LA, Siqueira MM et al. Mutual interference on the immune response to yellow fever vaccine and a combined vaccine against measles, mumps and rubella. Vaccine 2011; 29:6327–34
19. Kuhn S, Twele-Montecinos L, MacDonald J, et al. Case report: probable transmission of vaccine strain of yellow fever virus to an infant via breast milk. CMAJ 2011; 183:E243
20. Traiber C, Amaral P, Ritter V et al. Infant meningoencephalitis caused by yellow fever vaccine virus transmitted via breastmilk. J Pediatr (Rio J). 2011;87(3):269-272
21. Lindsey NP, Schroeder BA, Miller ER, et al. Adverse event reports following yellow fever vaccination. Vaccine 2008;26:6077–82.
22. Khromava AY, Eidex RB, Weld LH, et al. Yellow fever vaccine: an updated assessment of advanced age as a risk factor for serious adverse events. Vaccine 2005;23:3256–63.
23. São Paulo. Secretaria de Estado da Saúde Coordenadoria de Controle de Doenças Centro de Vigilância Epidemiológica “Prof. Alexandre Vranjac” Divisão De Imunização. Documento Técnico Vacina Febre Amarela – Fevereiro 2017. Disponível em http://www.saude.sp.gov.br/resources/cve-centro-de-vigilancia-epidemiologica/areas-de-vigilancia/doencas-de-transmissao-por-vetores-e-zoonoses/doc/famarela/famarela17_informe_vacina_fev.pdf
24. CDC. Transfusion-related transmission of yellow fever vaccine virus—California, 2009. MMWR 2010; 59:34–7.
25. World Health Organization. International travel and health: world–yellow fever vaccination booster, June 5, 2014. Geneva, Switzerland: World Health Organization; 2014. Available at http://www.who.int/ith/updates/20140605/en.
26. Martins RM, Pavão ALB, Oliveira PMN, Santos PRG, Carvalho SMD, Mohrdieck R, Fernandes AR, Sato HK, Figueiredo PM, Doellinger VR, Leal MLF, Homma A, Maia ML. Adverse events following yellow fever immunization: report and analysis of 67 neurological cases in Brazil. Vaccine 2014;32:6676-82.



